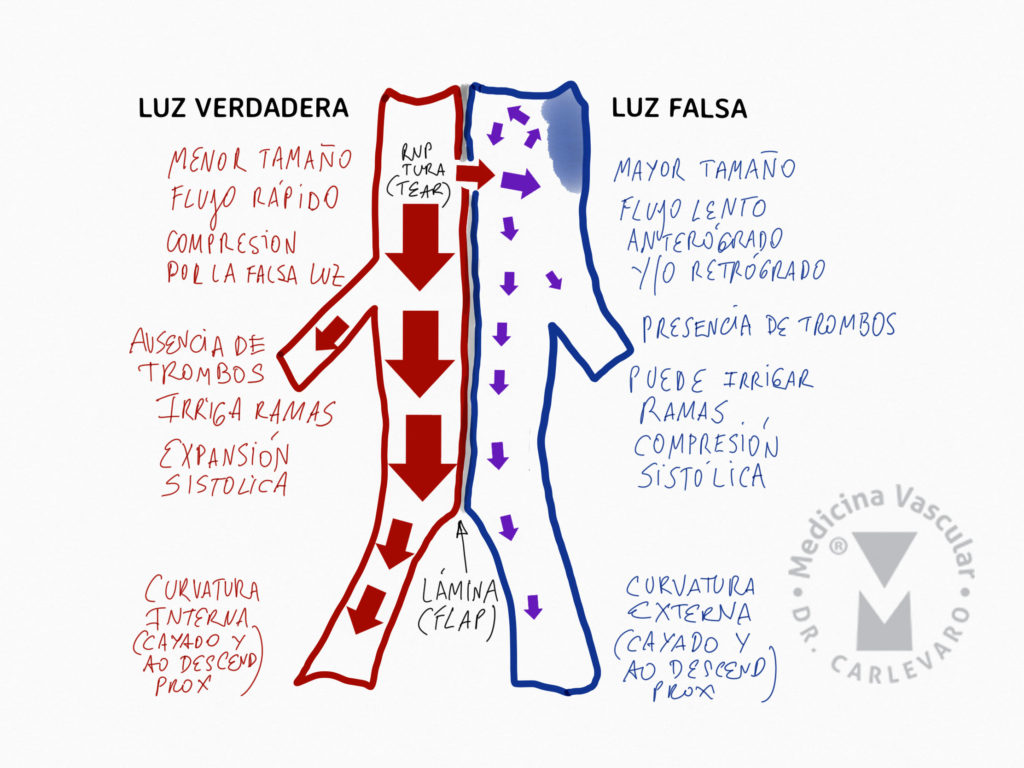
La disección de la aorta es una patología grave que es mortal si no se realiza tratamiento. Esta puede dicidirse temporalmente en aguda, subaguda o crónica, dependiendo del tiempo de evolución pasado desde el inicio del cuadro. Existen varias definiciones de acuerdo a diferentes sociedades cientificas, pero habitualmente se considera aguda dentro de los primeros 14 dias. Existen diferentes periodos de tiempo para la subaguda, que se considera entre los 15 y los 90 días, y la fase crónica, variando entre los 14 y 90 días. Algunos pacientes que sobreviven la fase crónica, desarrollan con el correr de los meses o años, la degeneración aneurismática y la ruptura de la aorta. La disección consta de una luz verdadera y de una luz falsa, la cual habitualmente es perfundida por una zona de ruptura intimal o desgarro. Existen características típicas de ambos espacios, como por ejemplo: la luz verdadera es de menor tamaño, tiene flujo rápido, se expande en sístole, mientras que la luz falsa es de mayor tamaño, flujo lento, puede presentar trombosis y se expande en diástole (Figura 1).
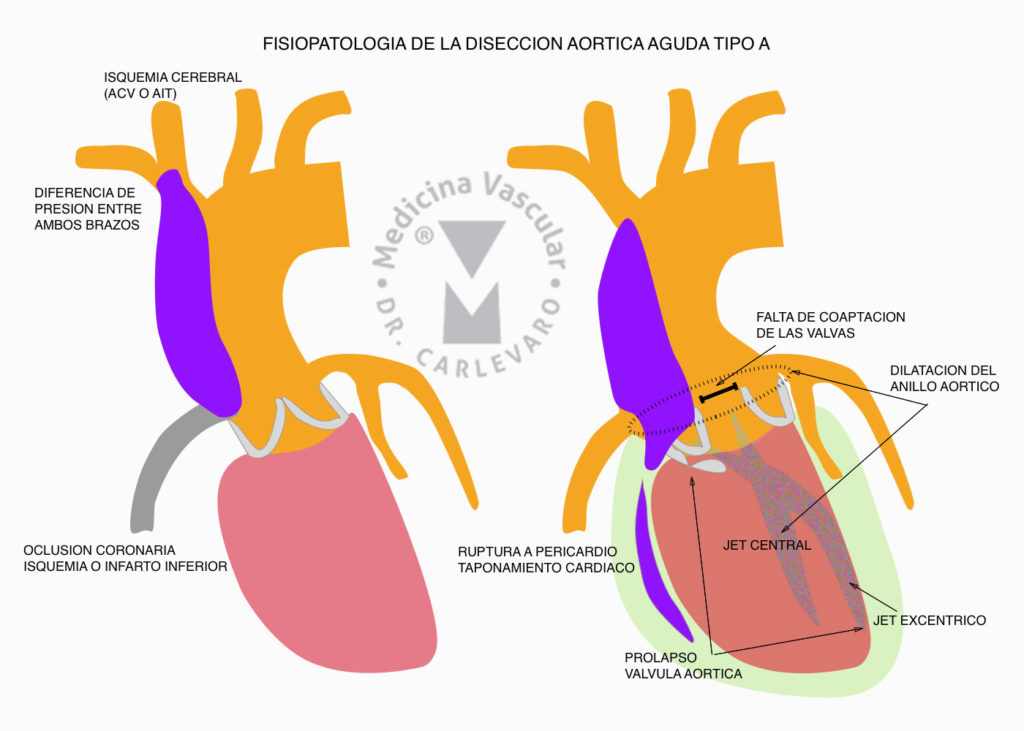
El objetivo terapéutico es el sellamiento del desgarro mediante el implante de una endoprótesis o stent cubierto, lo que impide el paso de la sangre hacia la falsa luz con la consecuente trombosis de la misma, proceso que se denomina remodelado aórtico. La disección puede comprometer la totalidad de la aorta o ser parcial. Básicamente es importante distinguir si la misma compromete la aorta ascendente ya que clínicamente es diferente al compromiso de la aorta descendente, ya que provoca dilatación y deformación de la aorta ascendente con eventual compromiso valvular que desencadena insuficiencia aórtica aguda, o la falsa luz se rompe al pericardio, ocasionando taponamiento cardíaco, o la disección se extiende a las coronarias provocando infarto de miocardio o accidente cerebrovascular si compromete los vasos de cuello (Figura 2).
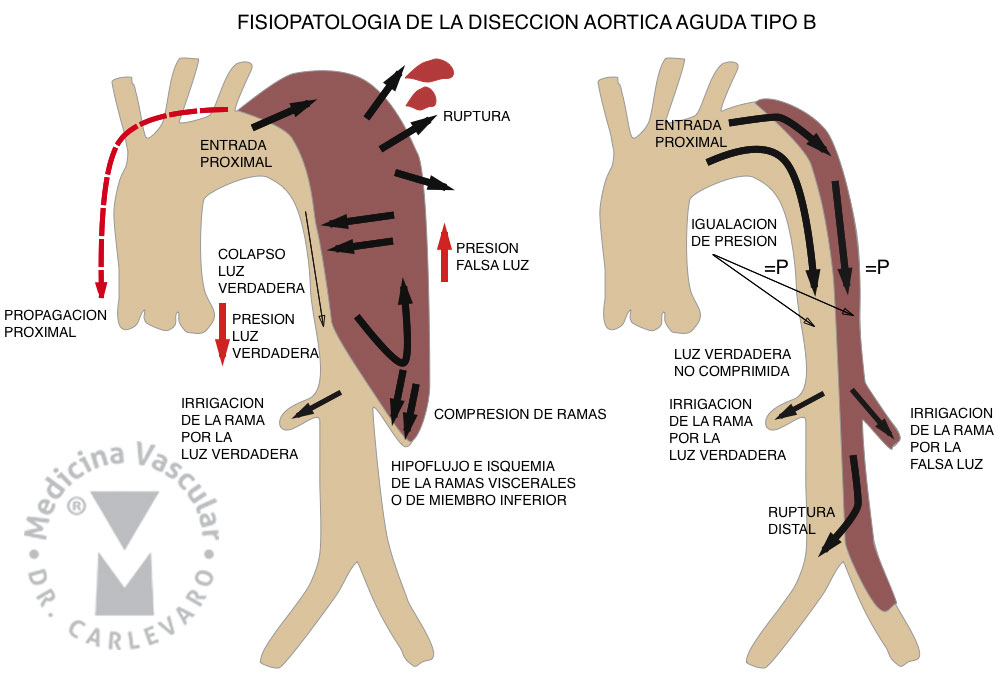
En el caso de la aorta descendente también puede romperse en forma aguda y provocar hemotórax o hemomediastino, o comprimir la salida de los vasos viscerales con la consecuente isquemia mesentérica, insuficiencia renal o isquemia de miembros inferiores si llega hasta las ilíacas. Es habitual que algunas arterias viscerales se perfundan por la falsa luz, lo que implica consideraciones importantes en el caso de que se produzca trombosis de la misma espontánea o gracias al tratamiento con endoprótesis (Figura 3).
Clasificación: se considera aguda en el caso de que tenga menos de dos semanas de evolución. Desde las dos semanas a los tres meses de evolución se considera subaguda y luego de los noventa días crónica. También se la puede clasificar de acuerdo a su localización, especialmente tomándose en cuenta el compromiso de la aorta ascendente (ver figura de clasificación de Stanford y DeBakey). La disección tipo A en general se trata mediante la cirugía cardiovascular, reemplazando la aorta ascendente y eventualemente la válvula aórtica, mientras que la disección tipo B, cuyo desgarro se encuentra habitualmente dista a la arteria subclavia izquierda, puede tratarse médicamente o mediante el implante de endoprótesis en caso de complicaciones (Figura 4).

Los desgarros intimales no sólo ocurren en la aorta ascendente y en el origen de la arteria subclavia izquierda, si no que es habitual además la presencia de desgarros distales a nivel de los vasos viscerales o en la aorta distal o en las arterias ilíacas. Estos desgarros distales hacen que la falsa luz pueda seguir perfundiéndose a pesar del sellado del desgarro proximal mediante la endoprótesis y provocar la dilatación progresiva de la aorta. Las ramas viscerales pueden estar irrigadas por la luz verdadera o la falsa: de manera típica el tronco celíaco, la mesentérica superior y la renal derecha salen de la luz verdadera, mientras que la renal izquierda se irriga por la falsa luz.
Etiologías: el sindrome de Marfan, la aorta bicúspide, hipertensión, abuso de cocaína, etc.
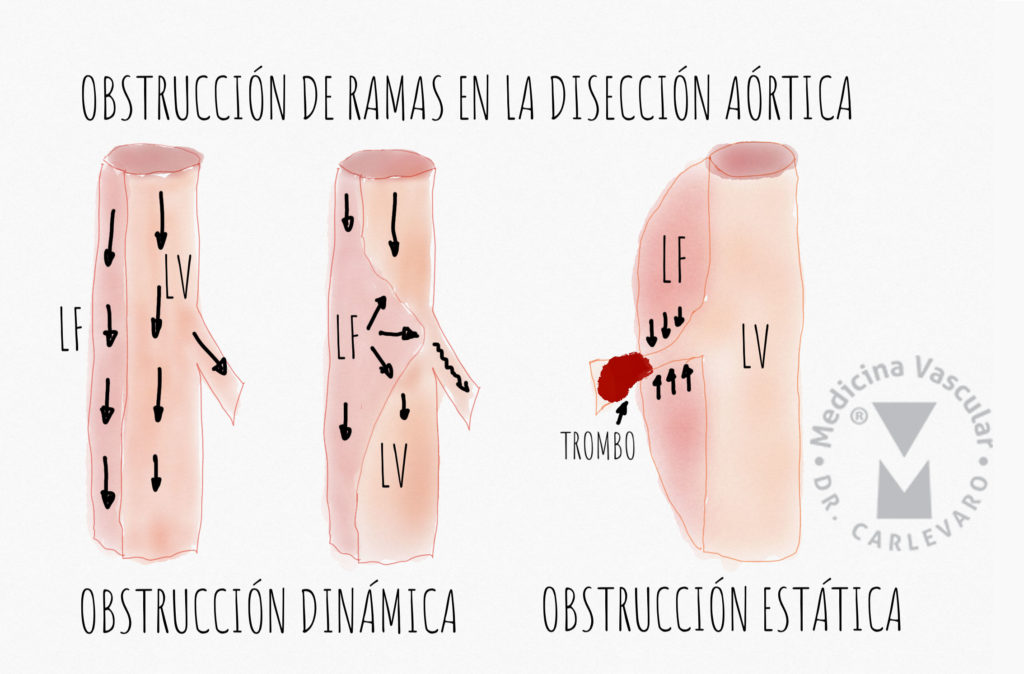
Fisiopatología: en el momento agudo de la disección la luz verdadera es comprimida por la falsa luz, siendo esta más grande, lo que incluso puede provocar el colapso de aquella. En la tomografía computada en fase aguda, una manera de distinguir la luz verdadera es que es más pequeña, y muchas veces con mayor tinción de contraste. La falsa luz comprime en mayor medida a la verdadera en caso de que no tenga una salida distal, por lo que presenta mayor presión. Esto puede ocasionar hipoperfusión generalizada distal. Existe un mecanismo de isquemia dinámico, caracterizado por el desplazamiento de la tela de disección con el ciclo cardíaco, lo que puede ocluir en forma transitoria el ostium de alguna rama visceral. Existe otro mecanismo estático de isquemia que ocurre cuando la falsa luz hipertensiva comprime la luz verdadera de la rama aórtica por propagación de la disección en dicha rama (Figura 5).
Presentación clínica: el dolor intenso es común y sigue el trayecto de la disección, por lo que puede ser precordial, en el dorso, o en la zona lumbar cuando se propaga hasta las ilíacas. La hipertensión es tambièn muy frecuente durante la presentación, mientras que la hipotensión en un paciente con disección tipo A debe hacer sospechar la ruptura en pericardio con taponamiento cardíaco. La diferencia de presión entre los brazos puede significar el compromiso de los vasos del cuello. También este compromiso puede manifestase por síncope o sintomas neurológicos. La paraplejía por compromiso espinal es rara. En la disección tipo B es frecuente el dolor intenso y pueden detectarse síntomas de isquemia visceral, como dolor abdominal, ileo, falta de pulso o isquemia de los miembros inferiores o insuficiencia renal.
Métodos de diagnóstico: los más importantes son la ecografía cardíaca y abdominal, la tomografía computada con contraste, el ecocardiograma transesofágico y la resonancia magnética. La aortografía invasiva pasó a un segundo plano y solo se utiliza para el tratamiento o para descartar compromiso coronario o de las ramas del cayado o viscerales.
Rx de tórax: es un método que puede inducir a la sospecha de la patología en el caso de observar el mediastino ensanchado en un paciente con dolor precordial, y tambíen si hay evidencias de líquido en la pleura izquierda, lo que puede hacer sospechar la ruptura con hemotórax.
Tomografía: permite ver la tela de disección, la luz falsa y la verdadera más pequeña, y las características de la tela permiten determinar anatómicamente si la disección es aguda o crónica (la tela fina y curvada es aguda, mientras que si es recta y gruesa es crónica). La luz verdadera es pequeña en la fase aguda comparada con la luz falsa y además es convexa, mientras que la luz falsa es más grande y cóncava, puediendo observarse además la presencia de trombosis o de líneas de tejido denominadas ¨cobweb¨ (telas de araña) (Figura 6).

Ecocardiograma: el ecocardiograma transtorácico permite ver la dilatación de la aorta ascendente y a veces la hoja de disección. Tambien diagnostica la ruptura a pericardio con taponamiento. Permite evaluar la presencia y severidad de la insuficiencia aórtica. El transesofágico presenta mayor calidad de imagen y permite adicionalmente observar la zona de desgarro y el flujo en la luz falsa así como la presencia de trombos en la misma. La resonancia es excelente para realizar el diagnóstico como la tomografía, pero no esta disponible en emergencias, no se puede realizar el estudio monitoreando al paciente y además tiene tiempo de examen largos.
Tratamiento de la disección tipo B: el tratamiento médico es el inicial y consiste básicamente en calmar el dolor y controlar la hipertensión. Si la aorta descendente está aneurismática en las fases iniciales existe mayor posibilidad de ruptura. Este es un motivo de indicar tratamiento endovascular con endoprótesis. Otras indicacion es la ruptura en pleura o el comrpomiso isquémico distal (hipoperfusión). En el caso de las disecciones crónicas la causa más frecuente de intervención es la dilatación aneurismática en pacientes no intervenidos en la fase aguda o distal al implante de la endoprótesis torácica, debido a la persistencia de flujo en la falsa luz. La opción quirúrgica a cielo abierto en el caso de la disección tipo B se utiliza poco ya que su mortalidad es mayor que la del tratamiento médico.
Tratamiento endovascular: recordemos que el objetivo es sellar la ruptura proximal, eliminando la presurización de la falsa luz, induciendo la trombosis de la misma y como consecuencia final el aumento del tamaño de la luz verdadera. Este proceso se denomina remodelado aórtico. El tratamiento proximal además puede mejorar la perfusión distal reduciendo el compromiso de las ramas. En general se coloca la endoprótesis tratando de cubrir dos centímetros proximales a la ruptura, lo que implica en ocasiones la cobertura del origen de la arteria subclavia izquierda. Para evitar reducir la perfusión medular con la oclusión subclavia, puede realizarse previamente un by-pass carótido subclavio o introducir en paralelo a la endoprótesis un stent cubierto, tipo chimenea, para mantener la perfusión del vaso. En general se observa trombosis de la falsa luz en todo el trayecto cubierto por la endoprótesis, mientras que en los segmentos distales es habitual que continue la perfusión en la falsa luz. Los segmentos distales no tratados deben se controlados en el seguimiento a largo plazo para evaluar la degeneración aneurismática. Los factores que parecen influenciar la dilatación de la aorta son la hipertensión mal controlada, el diámetro mayor a 4 cm en la fase aguda, la permeabilidad permanente de la luz falsa, un desgarro mayor a 10 mm y trombosis parcial distal de la luz falsa (Figuras 7, 8 y 9).
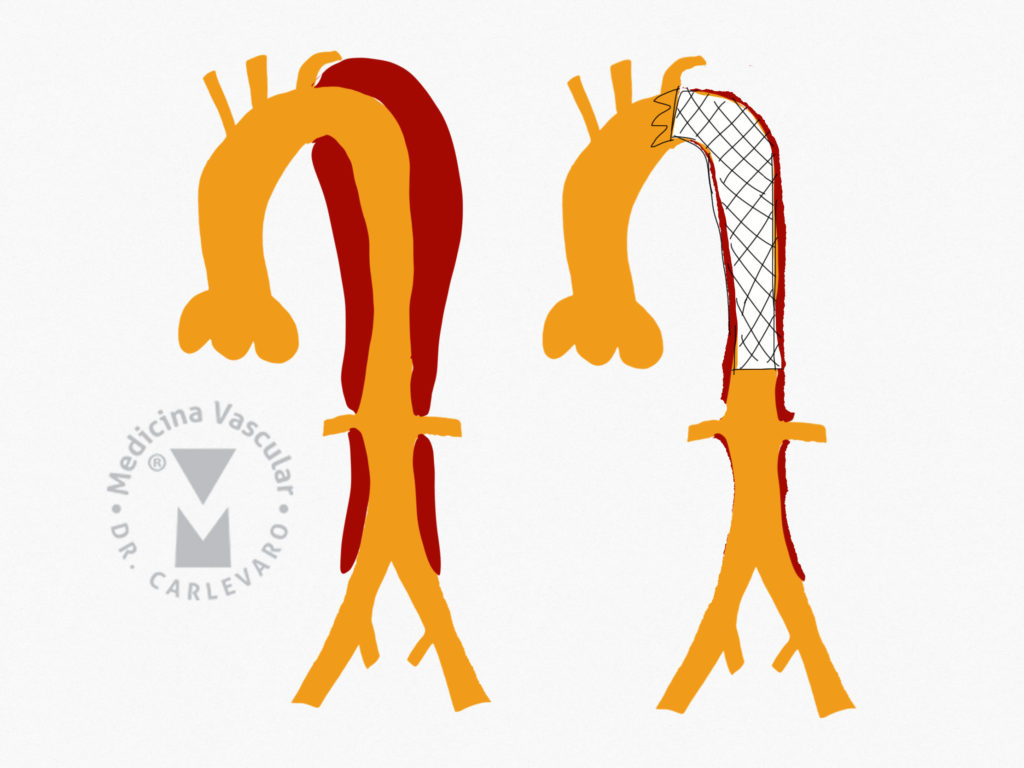
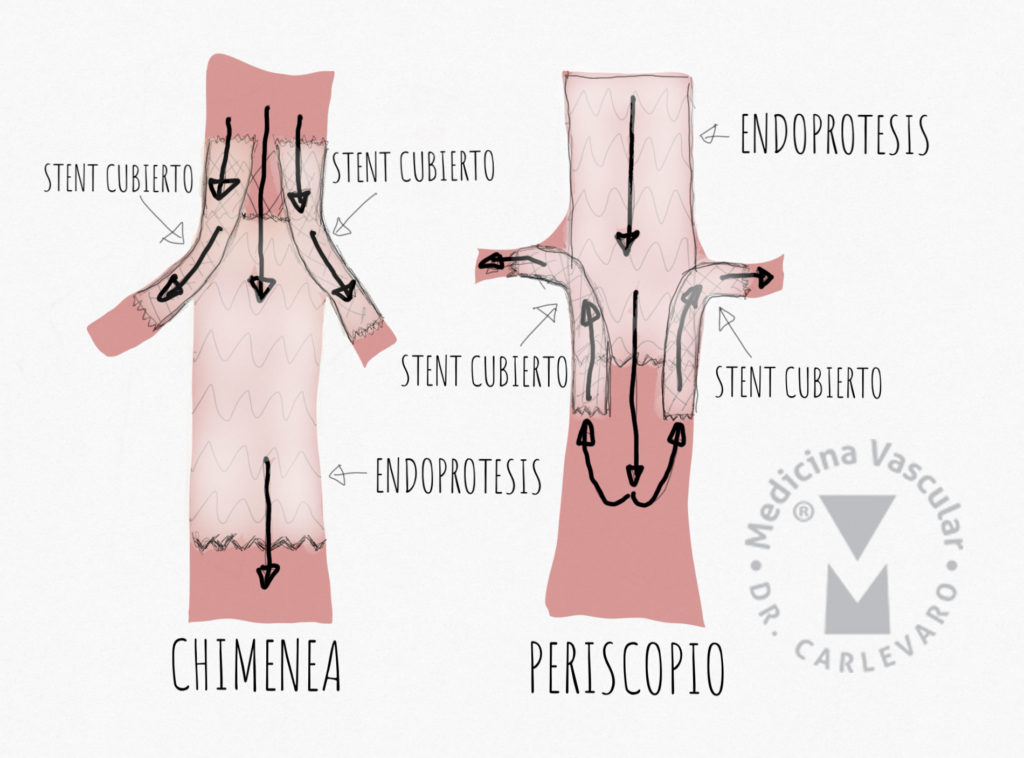
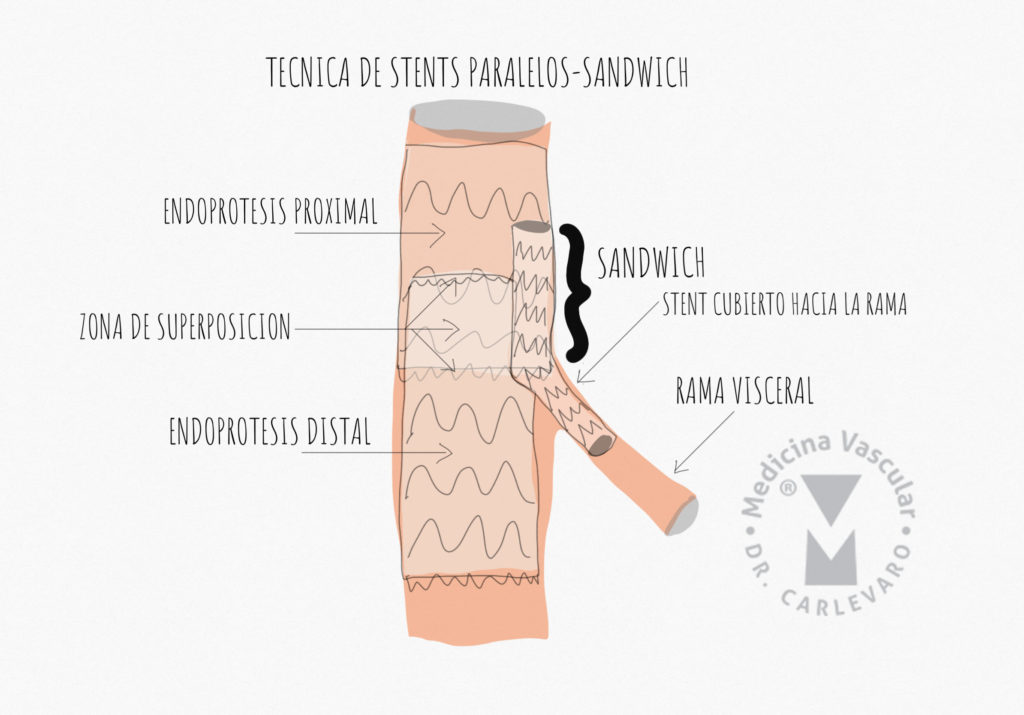
Manejo endovascular de las dilataciones aneurismáticas tardías:
Como la dilatación aneurismática de la aorta en la disección crónica involucra a los vasos viscerales (tronco celíaco, mesentérica superior y ambas arterias renales), el tratamiento endovascular debe involucrar la utilización de endoprótesis fenestradas o de ramas. Estas técnicas se denominan FEVAR y BEVAR, y no se utilizan sólo para disección, si no que también para tratar aneurismas yuxtarrenales, toracoabdominales y paraviscerales. Existe abundante bibliografia donde se demuestran excelentes resultadis y una reducción progresiva de las complicaciones, especialmente paraplejía e insuficiencia renal. Las prótesis fenestradas tienen agujeros en la tela orientados y alineados con el ostium de la rama visceral a proteger, mientras que las prótesis de ramas tienen pequeños apéndices que sirven de intermediarios entre la prótesis y los ostium de las ramas, espacio que se conecta mediante el uso de stents cubiertos (Figura 10).

Bibliografía:
- Rutherford´s Vascular Surgery and Endovascular Therapy, 9th Edition. Sidawy A. y Perler B. Chapter 81: Aortic Dissection, pág. 1057-1068. Elsevier, 2019.
- Brawnwald´s Heart Disease: A Textbook of Cardiovascular Medicine, 11th Edition. Elsevier, 2019.
- Patel R. et al. Endovascular Aortic Aneurysm Repair with Chimney and Snorkel Grafts: Indications, Techniques and Results. Cardiovascular and Interventional Radiology 36: 1443-1451; 2013.
- Kansagra K. et al. Advanced endografting techniques: snorkels, chimneys, periscopes, fenestrations and branched endografts. Cardiovascular Diagnosis and Therapy (suppl 1): S175-S183; 2018.
- Oderich G. et al. Endovascular repair of thoracoabdominal aortic aneurysms using fenestrated and branched endografts. Journal of Thoracic and Cardiovascular Surgery 153: S32-S41;2017.
